《肝癌电子杂志》2015 年第 2 卷第 2 期

黄凯文(台湾大学附设医院癌症微创介入治疗中心 台湾大学附设医院外科部暨肝炎研究中心 台湾大学医学院临床医学研究所,台北 000222)
【摘要】目的 消融治疗已成为肝癌的主要的治疗工具之一,然而长在高危区域如胆管旁,仍然一直是治疗死角,消融风险极高且效果不佳。本研究将介绍不可逆电穿孔治疗在此一领域的突破,并验证根据此原理的纳米刀治疗,对胆管、血管旁肝癌的治疗安全性及有效性。方法 台大医院于2011~2013 年收集 32 位肝癌病患,肿瘤均位于主要胆管及门脉旁5mm之内,符合 BCLC 期之A期标准,但不适合手术。这些病人在全身麻醉之下,以超声导引接受纳米刀肿瘤消融,治疗方法涵盖经皮穿刺(28人),腹腔镜下治疗(2人)以及开腹消融(2人),共治疗 35颗肿瘤,其中肝细胞癌 32 颗,合并胆管细胞癌 2 颗,大肠癌肝转移1颗,肿瘤平均大小为2.2cm,使用探针数量为2~5 针。结果 病人术后平均随访 22个月(14~-32个月),消融区邻近血管胆管均无损伤,其中12颗肿瘤同时贴近胆囊,15颗贴近胃肠道,术后也未见胆囊或胃肠道并发症,共发生其他并发症两例(6.2%),完全消融率91.4%,局部复发率为6.2%,无恶化存活期为20.8个月(14~32个月),随访期间无人死亡。
结论 本临床试验为亚太地区最早有系统的前瞻性纳米刀肝癌临床研究,结果证实不管是经皮、开腹或腔镜下进行超声导引纳米刀治疗,都不失为一个安全有效的方法,同时对于肝癌、胆管癌或是大肠癌的病例,在本研究中都证实纳米刀有临床的价值。
【关键词】肝癌;不可逆电穿孔;消融;纳米刀
1 介绍
消融治疗由于兼具微创(mini-invasive)及根治(radical)两大优点,在近年已成为普世接受的主要肝癌疗法 [1],随着微波凝固,多刀头(multielectrodes)射频等大范围消融工具的开展,肿瘤消融的大小上限也逐渐扩大,治疗时间日益缩短。在日本、中国台湾等国家和地区,消融早已取代手术成为早期肝癌的最常用治疗。可惜当肿瘤位于某些消融治疗死角时,例如靠近胆管、肠胃、肝脏表面等高危区域,由于剧烈温度改变会造成脏器损伤[2],又或是靠近血管处会降低消融效果[3],均成为了消融治疗使用时的一个限制,这些民众也因此被迫放弃有效的消融治疗,殊为可惜。
有别于传统冷热消融,纳米刀另辟蹊径,运用了全新的治疗原理:以多只细针导入的高压电场在细胞膜表面产生不可逆电穿孔(irreversible electroporation)效应,致使场区内细胞凋亡(apoptosis)[4],而由于此原理并非经由高热,消融区中组织架构及细胞间质仍能保持型态的完整。这样的消融方式除了能有效灭除肿瘤之外,在动物实验中也已确定治疗区内及外围血管、神经、胆管等结构可以保持无损[5],藉由纳米刀,我们因此能够安全地治疗位于高危地区的肿瘤,同时得以避免热沈效应(heat sink effect)对消融范围的影响,而得以消融邻近大型血管的肝癌 [6,7]。纳米刀的问世,使得消融治疗被提升到另一境界,更加安全有效。
2 方法
纳米刀系统在2006年取得FDA认证,在亚洲滥觞于中国台湾地区,台湾大学附设医院自2010年开始运用于肝胆胰肿瘤消融,为了确立此新技术适当的治疗适应证以及验证其安全性,本院于2011年起进行了一个单中心前瞻性研究,对于肿瘤邻近胆管、血管且不适手术之肝癌病患,在取得知情同意后进行纳米刀消融治疗,术后每 3 个月随访。本研究收案适应证如下:病患肝硬化程度为Child A-B,肝癌位于总胆管或是左右肝内胆管5mm以内,同时距门脉或左右门脉5mm以内者,肿瘤大小5cm之内,数量3颗之内,无肝脏外恶性肿瘤存在,无凝血不良异常,无心脏病史,无体内金属植入物如起搏器或金属支架,同时也必须通过全身麻醉风险评估。本研究经由临床试验伦理委员会批准,并注册于clinicaltrials.gov (201010036D)。主要研究终点为纳米刀治疗肝癌后之安全性及有效性,次要终点则为治疗后之复发率以及存活率。
在治疗过程方面,所有治疗皆是使用2.1版本纳米刀主机(Nanoknife system; Angiodynamics, NY),以及 2~6只19G 的治疗探针,使用电压上限为3000伏特,电流上限为50安培,每两针间之脉冲数量为90~180次,电脉冲长度为70微秒[8-10]。以这些探针平行插入肿瘤或肿瘤外围,形成一高压电场包覆住整个肿瘤,以进行治疗,有未竟之处则另行移动针位,直至整个肿瘤含周围5~10mm安全范围均被消融为止。
治疗期间病患必须全程接受全身插管麻醉及深度肌肉松弛处理,否则电脉冲将引起肌肉剧烈收缩损伤及针尖移位等危险,同时每个电脉冲必须经由心律同步器(synchronizer; AccuSync, Milford, CT, USA)导引[11],跟随心跳在心博不反应期放送,以减少诱发心律不整的危险[12],治疗期间均由麻醉科医师严格监控。
探针置入方式可为经皮穿肝操作、开腹操作以及腹腔镜下操作,整个下针过程都在超声导引下进行。而下针方式之选择为根据影像导引的清楚程度来决定。本研究中所使用之探针原则上针尖长度2cm,两针之针距为2cm,释放电压为1500V/cm,这也是临床上最适合肝癌消融之参数组合[13],不过这些参数仍会因实际上肿瘤与外围组织相关位置或是根据电击效果而有所调整。经由主机软件之仿真消融范~围,可决定所需使用的探针数量以及下针位置(图 1),术者必须调整针位,用针数量以及相关参数来使得模拟消融区能涵盖肿瘤,如此方可开始进行不可逆电穿孔治疗 [14,15] 。当然下针之后也务必确保各针体保持齐头平行,同时针尖没有穿刺经过血管,同时最好离开脏器及管道5mm以上。针尖不平行将导致不可逆电穿孔区范围缩小,增加局部复发率[16],而穿刺血管有术后出血之风险,纳米刀针体在反复消融之时,有时温度会上升,距离脏器及管道太近有热损伤之虞。在本研究中,所用针数平均为3.5±0.88枚(2~5枚)。
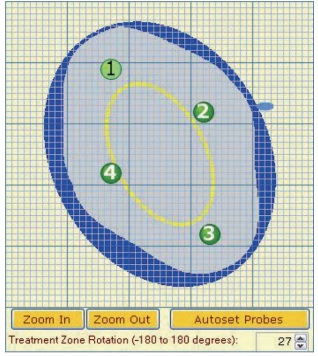
图 1 依肿瘤形状大小(黄圈),软件会建议我们使用探针数(4针),以及布针方式,在设定参数完毕后,将提供消融区范围的建议(灰圈)
本研究中所使用的平均电压为每对电极2370伏特(1800~3000V),平均电脉冲次数为每对电极135次(90~180 次)。治疗结束后可直接拔除探针,无须进行针道消融及额外止血处置,所有病人过程生命迹象稳定,术中有26 个病患出现20~30mmHg之收缩压上升,均在脉冲结束后恢复。
术后一天内收集尿液检查,心电图,并进行全血细胞计数、血清生化、电解质、甲胎蛋白及肌肉酵素分析,首周内每2天进行一次,2周及1个月后进行两次计算机断层检查以侦测并发症有无,术后每3个月进行一次随访。成功消融(technical success)是指术中所有下针电极对之预计治疗脉冲数均能成功完成,消融范围涵盖肿瘤,且术后3个月内显示肿瘤及外围区域增强消失,而局部复发(local recurrence)以术后造影影像在消融区外围1cm之内出现存活病灶来判定。
3 结果
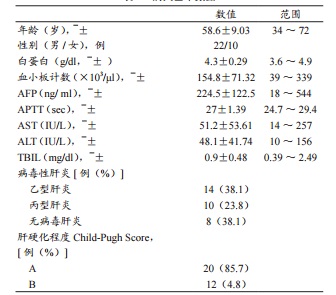
2011年至2013年本研究总共收案32位病人,22为男性,10位女性,平均年龄为58.6岁(表1),14人为乙型肝炎患者,10人为丙型肝炎患者,肝硬化程度 Child-Pugh Score A级为20人,B级为12人,6人为复发性肝癌,其中4 人接受过手术治疗,4人接受过射频消融,2人因阻塞性黄疸于总胆管内置放塑料质支架,至术前所有病患胆色素均正常,平均甲胎蛋白血中浓度为224.5ng/ml(18~533ng/ml)。
表1 病人基本数据
病患共进行35次纳米刀治疗(其中3人有2颗肿瘤),其中28人进行经皮治疗,2人开腹治疗,2人于腹腔镜下治疗,平均随访期为22个月(14~32 个月),术后病理证实2人为肝癌合并胆管细胞癌,1人同时有1颗肝癌,1颗大肠癌肝转移,故本研究中共治疗肝细胞癌32颗,合并胆管细胞癌2颗,转移性大肠癌1颗。肿瘤大小平均为2.2cm(1.0~4.4cm),85.7%(30/35)的肿瘤小于3cm。其中有12颗肿瘤同时贴近胆囊5mm之内,有11颗贴近大小肠壁,4颗贴近胃壁。
经皮穿肝治疗消融时间主要还是跟下针数量有关,平均下针时间为11分钟(5~19 分钟),纳米刀治疗时间为36 分钟(12~46 分钟),和开腹治疗下针与治疗时间无差异,腹腔镜导引下针时间延长为21分钟(18~24分钟),而治疗时间则无异。
在治疗中超声下可见高回音气泡聚集在探针周围,术后30分钟内有部分肿瘤出现低回音变化,但大多数肿瘤在术后初期无超声学上影像改变。30分钟后,80%(28/35)的消融区会出现会出现高回音外圈,可能为周围水肿所致。
纳米刀成功消融率为91.4%(32/35),其中一位病患虽完成消融,但影像上无变化,事后证实为机组故障,肿瘤也未完全消融。另两位肝癌病患经皮治疗术后3个月证实未完全消融,虽然术后甲胎蛋白曾下降至正常,且治疗1个月后之影像均无残余肿瘤迹象,由此可知纳米刀治疗近期内造影影像并无法正确诊断成功与否。这两位病患的肿瘤均大于为4cm,各使用了5根探针治疗,此3位病患均再次接受纳米刀或是射频消融治疗并完全消融。
术后疼痛方面轻微,经皮及腹腔镜治疗者仅使用acetaminophen(1000mg/d)1~4 天,两名开腹病患使用hydromorphone针剂(10mg)注射2及3次,之后各使用acetaminophen4天即可,术后住院日数于经皮及腹腔镜治疗病患平均为1.5天(1~4天),开腹病患为4天(3~5 天)。术后所有病患无出血,无感染,无气胸或脏器受损症状,一位开腹病患出现中量右侧胸水,呈现微喘,经抽取后改善,另一位肝硬化病患在经皮术后出现腹水,于术后7天就医,经保守疗法后改善出院。总计90天内并发症发生率为6.2%(2/32),无严重并发症,无死亡例。
2位出现并发症病患均为乙肝患者,肝硬化B级,均有糖尿病病史,均为肝脏手术后复发病患,肿瘤一在第四段,大小为2.8cm,开腹下以4只探针进行治疗,一在第七段,大小为3.2cm,以5只探针进行经皮治疗。由于并发症数量太少以致难以分析,不过,可见病毒性肝硬化病患,具糖尿病病史,曾经手术切除后复发者,进行开腹式治疗,大肿瘤及使用多探针似乎较好发并发症。术后血液分析可见首日低度白血球上升,总胆红素值上升0.6 mg/dl (0.2~1.3mg/dl),AST 上升90IU/L(45~792IU/L),ALT上升122IU/L(59~875IU/L),alkaline phosphatase上升12IU/L(-2~145IU/L),肌肉酵素creatine kinase上升达140IU/L(12~210IU/L),但96.9%病患均在7日内恢复正常。其他术后心电图变化,肾脏功能指数或是尿液分析均为正常,一个月内影像上未见胆管受损迹(图2),也无肝脏缺血坏死区出现,但无肝内脓疡出现。
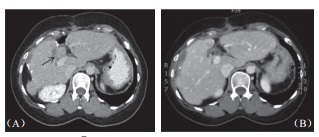
图2 62 岁男性肝癌病患在接受手术及射频消融后于总胆管及门脉旁复发,(A)3cm×2.8cm 大小肿瘤(箭头处)直接贴近肝门;B)消融后6个月肿瘤消失,消融区缩小明显,邻近胆管无扩张
平均整体存活期为22个月(14~32 个月),2个病人在术后第6及第9个月发现局部复发(6.2%),2个病人在第9及第18个月于肝内他处出现复发(6.2%),这4个病人均接受后续射频消融治疗成功,所有病患无恶化存活期为 20.8 个月(14~32个月)。
本研究中所治疗之肿瘤均贴近血管,随访期间也未见血管狭窄或栓塞(图3),影像上也未见受波及胆管进一步扩张或狭窄,只有一位在第9个月出现局部复发的病患,出现轻微胆管扩张,但无胆红素上升之异常。在12个贴近胆囊及15个贴近肠胃壁的肿瘤消融之后,仅有一位(8.3%)在术后超声中出现无症状的胆囊壁水肿,而在1个月后改善,无任何肠胃道受损或消化受影响的迹象。两人术前曾放置胆管内塑料质支架,术后移除时经检视支架无损伤,移除后也不再黄疸。
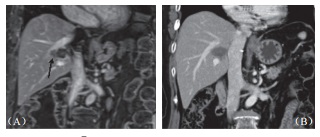
图3 55 岁男性肝癌病患在接受射频消融后右肝静脉及右侧门脉旁复发,(A)2cm×1.5cm 大小肿瘤(箭头处)直接侵犯右肝静脉;(B)消融后 6 个月血管内及血管侧肿瘤消失,仅余前度射频消融遗迹,邻近血管无损伤
4 讨论
纳米刀是一个相对新颖的消融工具[17],在许多临床前及临床研究中均提出有可能保全肿瘤周边重要结构以及避免热沈效应[4,18-20]。而所运用的电穿孔效应(electroporation),指的是细胞膜在非常快速,高电压的多次电脉冲下,出现穿孔,以致通透性改变的过程[21-23],当供给电压够高,脉冲够长之时,会出现不可逆电穿孔效应,让细胞呈现凋亡[23],不过一旦电压过大,则会出现高热,致使组织受热凝固性坏死[45],如此则完全失去电穿孔效应的意义。所以纳米刀治疗技术能不能达到最佳的不可逆电穿孔效应,取决于术者必须调整脉冲数量、电压、脉冲长度、电极位置和数目等多种参数,相对比传统消融复杂。
Al-Sakere[24]最早证实不可逆电穿孔治疗可以用来消融肿瘤,该团队成功治疗了小鼠皮下肉瘤,同样的成效在其他疾病模式如肝癌也被证实[25],而接着在Charpentier和其他专家的若干猪只实验中则观察到本疗法似乎不会造成严重的胆管损伤及黄疸[20,21,26]。这些结果都鼓励了后来医师将之使用在高危位置肿瘤消融上。Thomson[27] 在2011年最早提出临床上安全性相关报告,他整理了38个各种不同肿瘤治疗经验,证实纳米刀治疗之副作用效果都是可接受的。而在2014年Silk也发表研究指出以纳米刀治疗转移性肝肿瘤对邻近1cm内胆管影响有限[28]。
本研究则聚焦在贴近主要胆管及血管的原发性肝癌消融上,我们证实即使肿瘤仅距胆管血管5mm之内,没有任何胆管或血管在纳米刀治疗后出现变化,同时也没有出现相关症状,生化指标均只有短期的变化,其他安全指数如肾脏功能、血细胞数量均未见受影响,术后也未见心电图异常以及肌肉酵素上升。病患中仅有2人出现中度以下并发症(6.2%),同时无死亡病例,可见在适当的使用下,纳米刀对肝癌病患即使是有 Child B级肝硬化,安全性是可以确认的。而这并发症比例,和在安全位置进行射频消融相差无几[29]。
在治疗效果方面,本研究中治疗对象均为5cm以下,贴近血管之肝癌,而整体结果比之前 Narayanan 团队发表同样经皮纳米刀治疗结果为佳(无恶化存活11.6个月)[11],由于病患数量不够多,我们无法判断不同治疗途径对并发症以及治疗效果的差别,然而根据其他研究指出[18,27],经皮似乎比开腹消融有较高的局部复发机会,例如 Cannon[16]和Silk[28]主要以经皮计算机断层导引进行,出现40%~50% 的局部复发率,而Kingham等人[18] 以外科方法为主进行肝癌纳米刀治疗,却能达到6%局部复发率。虽然本研究绝大部分病患接受超声导引纳米刀治疗,完全消融率以及局部复发率都接近以外科方法进行的治疗结果,这显示经皮超声应该也是一种精准可行的纳米刀导引工具,而且能提供更低的治疗侵入性。
综观纳米刀治疗有几个与传统消融相异的特点 :第一,纳米刀系统治疗时病人需要接受全身插管麻醉以及完全肌肉松弛处理[9]。其二是治疗相对昂贵,所以仅建议使用于传统消融不适合之部位。第三是下针技术难度较高,纳米刀仅19G 粗,针身柔软,维持稳定直进不易,同时使用时必须多针平行下针。第四为所需应用的参数繁多,主机操作的复杂度,远大过传统冷热消融,稍有失调,不是效果不好,便是发热产生副作用[30-34]。最后,纳米刀治疗范围与传统消融比较下显得较小,在目前有限的临床经验中,已经得知纳米刀较适于用来治疗小于3cm 的肿瘤[14,16],3cm以上完全消融率也低,并发症也高,这是目前还无法克服的部分[16,27,35]。
5 结论
在这个前瞻性临床试验中,我们对贴近胆管的肝癌进行超声导引纳米刀消融,其中大部分病患为经皮穿肝操作,少部分为开腹操作或腹腔镜下进行,在全身麻醉及肌肉松弛下,与心律同步地进行每次电击治疗。术后并发症比例甚低,完全消融率及局部复发率可与位在安全区域肿瘤进行传统热消融的结果比肩。我们认为在熟练的操作及对不可逆电穿孔原理通盘了解的准备下,纳米刀对肝癌将是安全,且疗效优良的工具。
参考文献
[1] Sofocleous CT, Petre EN, Gonen M, et al. CT-guided Radiofrequency Ablation as a Salvage Treatment of Colorectal Cancer Hepatic Metastases Developing after Hepatectomy[J]. Journal of Vascular and Interventional Radiology, 2011, 22(6):755-761.
[2] Mulier S, Ni Y, Jamart J, et al. Local Recurrence After Hepatic Radiofrequency Coagulation: Multivariate Meta-Analysis and Review of Contributing Factors[J]. Annals of surgery, 2005, 242(2):158-171.
[3] Lu DSK, Yu NC, Raman SS, Limanond P, Lassman C, Murray K, Tong MJ, Amado RG, and Busuttil RWet al. Radiofrequency Ablation of Hepatocellular Carcinoma: Treatment Success as Defined by Histologic Examination of the Explanted Liver[J]. Radiology, 2005, 234(3):954-960.
[4] Davalos RV, Mir IL, Rubinsky B. Tissue ablation with irreversible electroporation[J]. Ann Biomed Eng, 2005, 33(2): 223-231.
[5] Moore MJ, Goldstein D, Hamm J, et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group[J]. J Clin Oncol, 2007, 25(15):1960-1966.
[6] Lee RC. Cell injury by electric forces[J]. Ann N Y Acad Sci, 2005, 1066:85-91.
[7] iller L, Leor J, Rubinsky B. Cancer cells ablation with irreversible electroporation[J]. Technol Cancer Res Treat, 2005, 4(6):699-705.
[8] Bower M, Sherwood L, Li Y, et al. Irreversible electroporation of the pancreas: definitive local therapy without systemic effects[J]. J Surg Oncol, 2011, 104(1):22-28.
[9] Martin RC, McFarland K, Ellis S, et al. Irreversible electroporation therapy in the management of locally advanced pancreatic adenocarcinoma[J]. J Am Coll Surg, 2012, 215(3):361-369.
[10] Martin RC, McFarland K, Ellis S, et al. Irreversible Electroporation in Locally Advanced Pancreatic Cancer: Potential Improved Overall Survival[J]. Annals of surgical oncology, 2012.
[11] Narayanan G, Froud T, Suthar R, et al. Irreversible Electroporation of Hepatic Malignancy[J]. Seminars in interventional radiology, 2013,30(1):67-73.
[12] Deodhar A, Dickfeld T, Single GW, et al. Irreversible electroporation near the heart: ventricular arrhythmias can be prevented with ECG synchronization[J]. AJR Am J Roentgenol, 2011, 196(3):W330-335.
[13] Ben-David E, Appelbaum L, Sosna J, et al. Characterization of irreversible electroporation ablation in in vivo porcine liver[J]. AJR Am J Roentgenol, 2012, 198(1):W62-68.
[14] Martin RC. Irreversible electroporation of locally advanced pancreatic head adenocarcinoma[J]. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract, 2013,17(10):1850-1856.
[15] Narayanan G, Hosein PJ, Arora G, et al. Percutaneous irreversible electroporation for downstaging and control of unresectable pancreatic adenocarcinoma[J]. J Vasc Interv Radiol, 2012, 23(12):1613-1621.
[16] Cannon R, Ellis S, Hayes D, et al. Safety and early efficacy of irreversible electroporation for hepatic tumors in proximity to vital structures[J]. J Surg Oncol, 2013,107(5):544-549.
[17] Chang DC, Reese TS. Changes in membrane structure induced by electroporation as revealed by rapid-freezing electron microscopy[J]. Biophysical Journal, 58(1):1-12.
[18] Kingham TP, Karkar AM, D'Angelica MI, et al. Ablationof perivascular hepatic malignant tumors with irreversible electroporation[J]. J Am Coll Surg, 2012, 215(3):379-387.
[19] Niessen C, Jung EM, Wohlgemuth WA, et al. Irreversible electroporation of a hepatocellular carcinoma lesion adjacent to a transjugular intrahepatic portosystemic shunt stent graft[J]. Korean journal of radiology : official journal of the Korean Radiol ogical Society, 2013, 14(5):797-800.
[20] Charpentier KP, Wolf F, Noble L, et al. Irreversible electroporation of the liver and liver hilum in swine[J]. HPB (Oxford), 2011, 13(3):168-173.
[21] Lee EW, Chen C, Prieto VE, et al. Advanced hepatic ablation technique for creating complete cell death: irreversible electroporation[J]. Radiology, 2010, 255(2):426-433.
[22] Onik G, Mikus P, Rubinsky B. Irreversible electroporation: implications for prostate ablation[J]. Technol Cancer Res Treat, 2007, 6(4):295-300.
[23] Rubinsky B, Onik G, Mikus P. Irreversible electroporation: a new ablation modality--clinical implications[J]. Technol Cancer Res Treat, 2007, 6(1):37-48.
[24] Sakere B, Andre F, Bernat C, et al. Tumor ablation with irreversible electroporation[J]. PLoS One, 2007, 2(11):e1135.
[25] Guo Y, Zhang Y, Klein R, et al. Irreversible electroporation therapy in the liver: longitudinal efficacy studies in a rat model of hepa tocellular carcinoma[J]. Cancer Res, 2010, 70(4):1555-1563.
[26] Lee EW, Thai S, Kee ST. Irreversible electroporation: a novel image-guided cancer therapy[J]. Gut and liver, 2010, 4 Suppl 1:S99-S104.
[27] Thomson KR, Cheung W, Ellis SJ, et al. Investigation of the safety of irreversible electroporation in humans[J]. J VascInterv Radiol, 2011, 22(5):611-621.
[28] Silk MT, Wimmer T, Lee KS, et al. Percutaneous ablation of peribiliary tumors with irreversible electroporation[J]. J Vasc Interv Radiol, 2014, 25(1):112-118.
[29] Poon RT, Ng KK, Lam CM, et al. Learning curve for radiofrequency ablation of liver tumors: prospective analysis of initial 100 patients in a tertiary institution[J]. Annals of surgery, 2004, 239(4):441-449.
[30] Faroja M, Ahmed M, Appelbaum L, et al. Irreversible electroporation ablation: is all the damage nonthermal? [J]. Radiology, 2013, 266(2):462-470.
[31] Davalos RV, Rubinsky B. Temperature considerations during irreversible electroporation[J]. International Journal of Heat and Mass Transfer, 2008, 51(23-24):561756-22.
[32] Olweny EO, Kapur P, Tan YK, et al. Irreversible electroporation: evaluation of nonthermal and thermal ablative capabilities in the porcine kidney[J]. Urology, 2013,81(3):679-684.
[33] Lencioni R, Crocetti L. Local-regional treatment of hepatocellular carcinoma[J]. Radiology,2012,262(1):43-58.
[34] Wiggermann P, Puls R, Vasilj A, et al. Thermal ablation of unresectable liver tumors: factors associated with partial ablation and the impact on long-term survival[J]. Med Sci Monit, 2012, 18(2):CR88-92.
[35] Philips P, Hays D, Martin RC. Irreversible electroporation ablation (IRE) of unresectable soft tissue tumors: learning curve evaluation in the first 150 patients treated[J]. PLoS One, 2013, 8(11):e76260.
收稿日期 :2015-03-12




 预约电话:
预约电话: 粤公网安备 44010602006223号
粤公网安备 44010602006223号
